Strona głowna » Badania Kliniczne
Badania kliniczne
- Wpływ dożylnego leczenia karboksymaltozą żelazową na śmiertelność i chorobowość z przyczyn sercowo-naczyniowych, oraz na jakość życia pacjentów z zawałem serca i towarzyszącym niedoborem żelaza - INFERRCT.
- Międzynarodowy i wieloośrodkowy program leczenia chłoniaków limfoblastycznych (LBL) dla dzieci i nastolatków.
- Wpływ nieodwracalnej elektroporacji wapniowej, elektrochemioterapii oraz elektroporacji (IRE-CaCl2, ECT oraz IRE) na jakość życia oraz przeżycie wolne od progresji u chorych na raka trzustki
- Development of an optimal strategy for the production and administration of CAR-T lymphocytes in adults and children with B-cell nonHodgkin lymphomas and acute lymphoblastic leukemia
- Zastosowanie specyficznych limfocytów przeciwwirusowych w leczeniu opornych zakażeń po allegenicznym przeszczepieniu hematopoetycznych komórek macierzystych
- Wieloośrodkowe, randomizowane, kontrolowane placebo badanie działania mirabegronu, nowego agonisty receptora β3–adrenergicznego, na masę i funkcję rozkurczową lewej komory u pacjentów ze strukturalnymi chorobami serca.
- Niekomercyjne badanie kliniczne dla potwierdzenia bezpieczeństwa i skuteczności terapii fagowej w leczeniu przewlekłego zapalenia zatok przynosowych - RHINOPHAGE
- Badanie kliniczne I/II fazy autologicznej terapii genowej z użyciem krwiotwórczych komórek macierzystych w ciężkim złożonym niedoborze odporności wywołanym mutacją w obrębie genu RAG1 - RECOMB
- Zastosowanie osocza ozdrowieńców w terapii chorych na Covid-19 wraz z metabolomiczną i laboratoryjną oceną postępu terapii osoczem - EPIC-19
- IntReALL 2010, niekomercyjne wieloośrodkowe badanie kliniczne nad leczeniem pierwszego nawrotu ostrej białaczki limfoblastycznej u dzieci
- Profilaktyka Wtórna Chorób Sercowo-Naczyniowych u Osób Starszych - SECURE
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel badania:
Ocena wpływu dożylnego (i.v.) leczenia karboksymaltozą żelazową (ang. ferric carboxymaltose, FCM) w porównaniu z placebo na śmiertelność i chorobowość z przyczyn sercowo-naczyniowych, oraz na jakość życia pacjentów z zawałem serca i towarzyszącym niedoborem żelaza w obserwacji 24-miesięcznej.
Oczekiwane efekty: Niedobór żelaza u chorych po zawale mięśnia sercowego nie jest diagnozowany i nie jest leczony (dlatego w badaniu podawanie i.v. karboksymaltozy żelazowej będzie porównane z placebo z predefiniowanymi punktami końcowymi). Oczekiwanym efektem zdrowotnym jest: poprawa rokowania w zakresie zmniejszenia śmiertelności i chorobowości sercowo-naczyniowej, w szczególności zmniejszenie ryzyka rozwoju niewydolności serca i związanych z tym konsekwencji (zmniejszenie aktywacji neurohumoralnej, zmniejszenie liczby hospitalizacji, a tym samym zapobieganie dalszej progresji choroby, poprawa jakości życia chorych i ich rodzin, utrzymanie aktywności zawodowej chorych, zmniejszenie kosztów związanych z drogim leczeniem niewydolności serca, czemu ma zapobiec ta interwencja).
Lead Principal Investigator: prof. dr hab. Piotr Ponikowski
Wartość projektu: 29 004 682,00 zł
Wartość dofinansowania: 29 004 682,00 zł
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2019/ABM/01/00081
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cele badania:
Zwiększenie odsetka dzieci trwale wyleczonych z chłoniaka limfoblastycznego. Badanie będzie prowadzone w oparciu o produkty lecznicze/metody leczenia już zarejestrowane, opisane i dostępne, ale w przypadku części z nich brak określonego w charakterystyce produktu leczniczego (chpl) – sposobu ich dawkowania w różnych grupach chorych (grupa niskiego lub wysokiego ryzyka), w zależności od wieku dziecka, jednoczesnego podawania innych cytostatyków lub chłoniaków (LBL) nie wymieniono we wskazaniach chpl. W klasyfikacji chorych do grup ryzyka, dla których przewidziany jest różny schemat leczenia będą brane pod uwagę czynniki prognostyczne, co do których istnieją dane naukowe, że mogą mieć istotny wpływ na rokowanie.
Są to: profil zmian molekularnych w tkance guza, stadium zaawansowania, immunofenotyp i brak/lub zajęcie centralnego systemu nerwowego (CNS). Miarą skuteczności leczenia będzie wzrost odsetka przeżyć wolnych od choroby. Badanie zaplanowano z udziałem 15 krajów europejskich, pod auspicjami Europejskiej Grupy Leczenia Nieziarniczych Chłoniaków Złośliwych (EICNHL).
Główny badacz: dr hab. Grażyna Wróbel
Wartość projektu: 9 060 765,01 zł
Wartość dofinansowania: 9 060 765,01 zł
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2020/ABM/01/00032
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel badania:
Założeniem badania jest pojawienie się nowej technologii medycznej pod postacią elektroporacji wapniowej (CaCl2) w leczeniu raka trzustki, która poprawi skuteczność leczenia i poprawi jakość życia pacjentów chorych na nowotwór trzustki.
Odkryciem ostatniej dekady jest elektroporacja- nowatorska metoda polegająca na destabilizacji błony komórkowej komórki nowotworowej, zwiększeniu jej przepuszczalności dla leków. Proces ten może zachodzić w sposób odwracalny (RE- reversible electroporation) lub nieodwracalny (IRE- irreversible electroporation).Prowadzi do śmierci komórki na drodze apoptozy. Ze względu na zmiany przepuszczalności błony komórkowej do procesu fizycznego zaczęto dodawać
chemioterapeutyki lub jony wapnia.
Tak powstała nowatorska metoda leczenia guzów litych- elektrochemioterapia (ECT- electrochemotherapy) i elektroporacja wapniowa.
W powyższym badaniu w źle rokującym raku trzustki zostaną zastosowane obie metody. Dla każdego pacjenta, indywidualnie, zostanie wybrany najlepszy „moment terapeutyczny” zabiegu. Leczenie będzie personalizowane dla każdego pacjenta.
Główny badacz: prof. dr hab. Wojciech Kielan
Wartość projektu: 9 407 825,26 zł
Wartość dofinansowania: 9 407 825,26 zł
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2019/ABM/01/00107
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel badania:
Projekt to badanie kliniczne fazy I/II, które przeprowadzone zostanie w grupie chorych na oporne/nawrotowe (R/R) DLBCL, HGBCL i dzieci chorych na B-ALL Cele badania obejmują m.in. określenie optymalnej dawki komórek CAR-T i ich składu, najniższej wyjściowej bezwzględnej liczby limfocytów T koniecznej dla produkcji komórek CAR-T, wpływu ekspresji PD1 na limfocytach T na żywotność komórek CAR-T oraz optymalizację limfodeplecji. Celem badania jest również ocena możliwości efektywnej produkcji komórek CAR-T w miejscu leczenia. Można przypuszczać, że dzięki proponowanemu badaniu opracowany zostanie model leczenia, który umożliwi dostęp do tej innowacyjnej terapii komórkowej już w pierwszej linii leczenia ratunkowego wybranej grupie chorych na chłoniaki agresywne i dzieci chorych B-ALL ze szczególnie niepomyślnym rokowaniem.
Główny badacz: prof. dr hab. Tomasz Wróbel
Wartość projektu: 15 561 577,32 zł
Wartość dofinansowania: 15 561 577,32 zł
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2020/ABM/01/00107
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel badania:
Badanie ma zapewnić dostęp do terapii ciężkich, opornych zakażeń wirusowych za pomocą VST w skali ogólnopolskiej.
Celem badania jest określenie bezpieczeństwa i wykonalności preparatów VST od dawców hematopoetycznych komórek macierzystych lub zdrowych, niespokrewnionych dawców.
Pierwszorzędowym celem będzie ocena zmniejszenia lub eliminacji wiremii po podaniu VST.
Drugorzędowymi celami będą ocena przeżycia pacjentów, określenie bezpieczeństwa VST, oznaczenie aktywności przeciwwirusowej we krwi biorcy VST i zbadanie okresu przeżywalności VST w okresie pierwszych 12 miesięcy po podaniu.
Uzupełniającym celem projektu jest stworzenie bazy zdrowych, niespokrewnionych dawców limfocytów w celu zapewnienia dostępu do terapii VST dla pacjentów nie posiadających optymalnego dawcy komórek.
Projekt naukowy obejmuje analizę skuteczności i bezpieczeństwa VST w zwalczaniu zakażeń wirusowych oraz określenie u dawców i biorców seroprewalencji i reaktywności przeciwwirusowej przeciwko badanym wirusom (ADV, BKV, CMV, EBV, JCV).
Główny badacz: prof. dr hab. Marek Ussowicz
Wartość projektu:16 960 562,80 zł
Wartość dofinansowania: 16 960 562,80 zł
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2020/ABM/01/00125
Wnioskodawca:
Katolicki Uniwersytet w Lowanium
Oude Markt 13
3000 Leuven
Belgia
Hipoteza badawcza:
Projekt BETA3_LVH oparty jest na następującej koncepcji: w badaniach laboratoryjnych prowadzonych w Institute for Experimental and Clinical Research of the Université Catholique de Louvain wykazano, że substancja czynna mirabegron może blokować specyficzne receptory β3-adrenergiczne, zlokalizowane na powierzchni komórek mięśnia sercowego. W kolejnych testach potwierdzono, że blokując receptory β3AR, można ograniczyć niekorzystny przerost komórek mięśnia sercowego.
Naukowcy, zachęceni tym odkryciem, postanowili przebadać skuteczność nowego zastosowania mirabegronu (leku standardowo wykorzystywanego w schorzeniach urologicznych) w leczeniu chorych z przerostem mięśnia sercowego. Założenia badawcze oparte są na obserwacjach, z których wynika, że organizm wykorzystuje ten sam szlak co mirabegron jako sposób ochrony w przypadku obciążenia serca. Dlatego możliwe jest, że testowana terapia będzie wspierała mechanizmy obronne organizmu.
W badaniu BETA3_LVH zostanie zbadanych 300 osób (w tym 33 w Polsce) z wieloletnim nadciśnieniem tętniczym, które spowodowało u nich niekorzystną przebudowę serca – przerost lewej komory i zmiany funkcji rozkurczowej. Części pacjentów będzie podawany lek, dotychczas nie stosowany w kardiologii, zawierający substancję czynną mirabegron. W rocznej obserwacji uczestników badania prowadzona będzie ocena kliniczna efektów terapii. Oceniana będzie skuteczność preparatu w leczeniu (ograniczeniu) przerostu mięśnia sercowego i/lub zmiany funkcji rozkurczowej, a w dalszej perspektywie w zapobieganiu rozwojowi niewydolności serca.
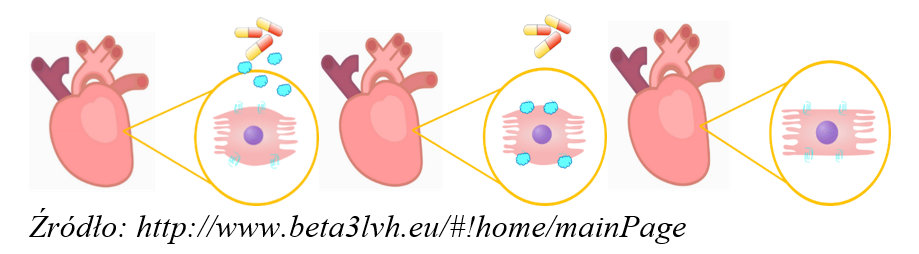
W badaniu BETA3_LVH zostanie zbadanych 300 osób (w tym 33 w Polsce) z wieloletnim nadciśnieniem tętniczym, które spowodowało u nich niekorzystną przebudowę serca – przerost lewej komory i zmiany funkcji rozkurczowej. Części pacjentów będzie podawany lek, dotychczas nie stosowany w kardiologii, zawierający substancję czynną mirabegron. W rocznej obserwacji uczestników badania prowadzona będzie ocena kliniczna efektów terapii. Oceniana będzie skuteczność preparatu w leczeniu (ograniczeniu) przerostu mięśnia sercowego i/lub zmiany funkcji rozkurczowej, a w dalszej perspektywie w zapobieganiu rozwojowi niewydolności serca.
Główny badacz: ppłk dr n. med. Bartosz Krakowiak
Całkowa kwota grantu: 5,425,112 €
Budżet dla UM Wrocław: 375 000 €
Źródło finansowania: Badanie jest finansowane z programu ramowego w zakresie badań naukowych i innowacji Unii Europejskiej „Horyzont 2020”. Umowa grantowa numer: 634559

Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel badania: Celem projektu jest przeprowadzenie niesponsorowanego randomizowanego badania klinicznego (BK) zastosowania terapii fagowej (TF) w leczeniu przewlekłego
zapalenia zatok przynosowych (PZZP) powikłanego infekcją gronkowcową.
Oczekiwane efekty:
potwierdzenie bezpieczeństwa i skuteczności zastosowania bakteriofagów (fagów) w leczeniu przewlekłego zapalenia zatok przynosowych (PZZP) powikłanego infekcją gronkowcową, w którym zakażenie gronkowcem złocistym jest bardzo często przyczyną istotnego pogorszenia stanu
klinicznego pacjenta z PZZP i jakości jego życia. Planowane BK będzie przede wszystkim modelowym badaniem typu „concept of proof”, którego pozytywne wyniki mogą otworzyć drogę do szerokiego zastosowania TF w leczeniu zakażeń bakteryjnych (obecnie w Polsce, EU i USA wymiarze eksperymentu leczniczego, expanded access czy compasionate use.
Lead Principal Investigator: dr hab. Tomasz Zatoński, prof. nadzw.
Wartość projektu: 15 405 394,71
Wartość dofinansowania: 15 405 394,71
Wartość dofinansowania UMW: 880 525,00
Okres realizacji projektu: 01.10.2022- 30.09.2028
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2022/ABM/01/00036
Wnioskodawca: Centrum Medyczne Uniwersytetu w Leiden
Rapenburg 70, 2311 EZ Leiden, Holandia
Cel projektu:
Celem badania jest sprawdzenie czy przeszczepienie zmodyfikowanych genetycznie komórek macierzystych jest bezpieczne i równie skuteczne jak przeszczepienie komórek macierzystych od dawcy (allogeniczne przeszczepienie krwiotwórczych komórek macierzystych – HSCT) u badanych osób cierpiących na RAG1-SCID. Terapia genowa przeciwko RAG1-SCID nie była dotychczas stosowana u ludzi. Jest ona jednak od wielu lat badana w warunkach laboratoryjnych, a jej skuteczność została potwierdzona w modelach przedklinicznych (zwierzęcych), w tym w modyfikacji ludzkich krwiotwórczych komórek macierzystych od pacjentów z niedoborem RAG1. W kilku innych wariantach genetycznych SCID, terapia genowa z zastosowaniem podobnej metody jak w niniejszym badaniu okazała się być skuteczna i bezpieczna dla pacjentów. W niniejszym badaniu wyniki terapii genowej przeciwko RAG1-SCID zostaną porównane z wynikami allogenicznego HSCT u pacjentów cierpiących na RAG1-SCID [zarejestrowanych przez Europejską Grupę ds. Przeszczepiania Krwi i Szpiku/Rejestr przeszczepów komórek macierzystych w leczeniu niedoborów odporności w Europie (SCETIDE registry)].
Badanie to zostało opracowane przez Centrum Medyczne Uniwersytetu w Leiden (LUMC), Holandia, i jest prowadzone przez lekarzy i badaczy w Leiden we współpracy z innymi międzynarodowymi szpitalami partnerskimi (Wielka Brytania, Niemcy, Włochy, Hiszpania, Polska, Izrael). W badaniu udział weźmie łącznie do 10 pacjentów z ośrodków uczestniczących w badaniu.
Główny badacz: prof. dr hab. Krzysztof Kałwak
Wartość projektu: 5 990 460,75 EURO
Wartość dofinansowania UMW: 57 000 EURO
Źródło finansowania: Badanie finansowane ze środków Unii Europejskiej w ramach projektu Horyzont 2020 (nr umowy 755170-RECOMB)
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel badania:
1. Ocena różnicy w odpowiedzi serologicznej u ozdrowieńców, którzy przebyli zakażenie SARS-Cov-2 bezobjawowo, a ozdrowieńców z objawami klinicznymi
COVID-19;
2. Ocena wpływu poziomu przeciwciał przeciwko SARS-Cov-2 (w klasie IgM, IgG, IgA) u ozdrowieńców na skuteczność terapii CP w COVID-19;
3. Określenie nowych markerów metabolomicznych we krwi dawców oraz biorców wpływających na i/lub warunkujących odpowiedź kliniczną po CP
4. Ocena bezpieczeństwa i skuteczności CP w terapii COVID-19 w populacji polskiej;
Główny badacz: prof. dr hab. Grzegorz Mazur
Wartość projektu: 3 060 000,00 zł
Wartość dofinansowania: 3 060 000,00 zł
Źródło finansowania: Badanie finansowane ze środków budżetu państwa od Agencji Badań Medycznych, numer Projektu 2020/AB
Wnioskodawca: Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
wyb. Ludwika Pasteura 1
50-367 Wrocław
Cel projektu: IntReALL 2010 to niekomercyjne wieloośrodkowe badanie kliniczne nad leczeniem pierwszego nawrotu ostrej białaczki limfoblastycznej u dzieci.
IntReALL jest międzynarodowym niekomercyjnym badaniem klinicznym nad optymalizacją protokołu leczenia pierwszego nawrotu ostrej białaczki limfoblastycznej (ALL) u dzieci. Protokół badania został zaprojektowany przez ekspertów europejskich w dziedzinie terapii nawrotów ALL u dzieci – Resistans Diseases Commitee. Grupa stworzyła dynamiczną platformę lntReALL optymalizującą terapię standardową oraz dostarczającą istotną statystycznie liczbę pacjentów do randomizowanego badania klinicznego nad kontrolowaną integracją obiecujących nowych leków w ramach leczniczej koncepcji ratunkowej.
Główny badacz: dr n. med. Monika Mielcarek – Siedziuk
Wartość projektu: 864 844 zł
Wartość dofinansowania: 864 844 zł
Źródło finansowania: Badanie finansowane ze środków Fundacji Na Ratunek Dzieciom z Chorobą Nowotworową oraz Fundacji DKMS
Wnioskodawca:
Hiszpańskie Narodowe Centrum Badań Układu Krążenia (CNIC) C. de Melchor Fernández Almagro, 3
28029 Madrid
Hiszpania
Hipoteza badawcza:
W projekcie o akronimie SECURE badana będzie skuteczność tabletki wieloskładnikowej (Polypill) w prewencji wtórnej chorób sercowo-naczyniowych, w populacji osób starszych.
W projekcie testowana będzie następująca hipoteza badawcza: stosowanie tabletki wieloskładnikowej – zawierającej trzy produkty lecznicze o udowodnionej skuteczności oraz wykazującej pozytywny wpływ na przestrzeganie zaleceń lekarskich – wpłynie na zmniejszenie występowania poważnych incydentów sercowo-naczyniowych u chorych po ostrym zawale mięśnia sercowego.
Osiągnięcie ww. celu zrealizowane będzie poprzez:
– obniżenie zawiłości terapii,
– zmniejszenie stopnia nieprzestrzegania zaleceń lekarskich,
– osiągnięcie lepszych wyników w kontroli czynników ryzyka chorób sercowo-naczyniowych,
– obniżenie ryzyka nawracających schorzeń oraz śmierci u starszych pacjentów z chorobami układu krążenia.
Badanie skierowane jest do kobiet jak i mężczyzn w wieku ≥ 65 lat, po przebytym zawale serca. W Polsce zaplanowano rekrutację łącznie 400 osób, w 7 ośrodkach na terenie kraju.

Główny badacz: prof. dr hab. Piotr Ponikowski
Całkowa kwota grantu: 5,998,786 €
Budżet dla UM Wrocław: 382 375 €
Źródło finansowania: Badanie jest finansowane z programu badań naukowych i innowacji Unii Europejskiej Horyzont 2020.